Opgesloten golven
Je weet dat in een klein muziekinstrument golven met hoge frequenties kunnen bestaan, en in een groot instrument golven met lage frequenties. In de snaar van een contrabas ontstaan lagere tonen dan in de snaar van een viool. Een grote klok klinkt lager dan een kleine, een altfluit lager dan een blokfluit.
Dit komt doordat vastligt wat de golflengte kan zijn. Bij een snaarinstrument kunnen de uiteinden van een snaar niet bewegen. Daardoor zijn alleen de staande-golfpatronen mogelijk die je in figuur 4.5 ziet. De bovenste mogelijkheid is de grondtoon, daarbij past een halve golflengte op de snaar. Er geldt λ=2L. Daaronder staan de boventonen, met λ=L, λ=2/3 L, enzovoort. De frequenties volgen uit f=v/λ, met v de golfsnelheid. Voor de boventonen is de golflengte kleiner en de frequentie hoger. Je ziet twee dingen: Niet alle golflengtes en frequenties zijn mogelijk, slechts veelvouden van de grondtoon kunnen bestaan. En bij een grotere afmeting L horen grotere λ’s en kleinere f’s.
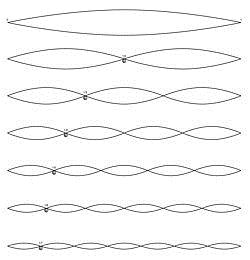
Figuur 4.5 Grondtoon en boventonen van een snaar
De mogelijke energieën van een elektron in een atoom worden op analoge manier bepaald als de boventonen van een muziekinstrument. Het gaat erom welke golven passen bij de beschikbare ruimte. Kenmerkend voor de elektronen in een atoom is dat ze te weinig energie hebben om aan de aantrekkingskracht van de kern te ontsnappen. Vrijwel alle waarneembare eigenschappen van atomen komen eruit voort dat de elektronen zich in deze beperkte ruimte als golf gedragen. In het atoom gaat het om de golf die samenhangt met de kansverdeling van de plaatsen waar het elektron wordt waargenomen. Bij elke mogelijke golf hoort een mogelijke energie.
We gaan niet in detail afleiden welke energieën een elektron in een atoom kan hebben. (Zie daarvoor de module Elektromagnetische straling en materie.) We gaan wel kijken hoe de energieniveaus afhangen van de afmetingen van de ruimte. We zullen het eerst hebben over het simpelste geval, namelijk met maar één elektron dat in een beperkte ruimte is ingesloten. Dat is van toepassing op een waterstofatoom. Later volgen atomen met meerdere elektronen.