Eigenschappen van de eerste twintig elementen
In figuur 4.14 zie je het periodiek systeem der elementen. Met de formule voor de energieniveaus en het Pauli-principe kunnen we veel eigenschappen van de elementen begrijpen.
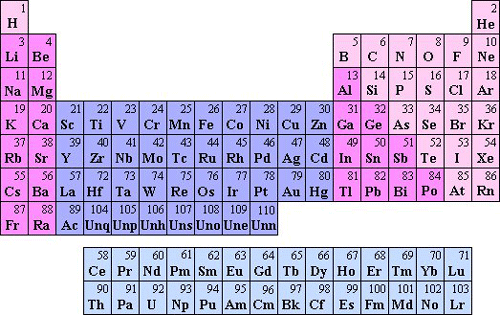
- Atoomnummer 1: Een waterstofatoom heeft slechts één elektron. Dat zit normaal gesproken in de laagste energietoestand. Het kost een energie van 13,6 eV om dit elektron los te maken. Dit gaat redelijk gemakkelijk. Als het elektron loskomt, houd je een los proton over. Losse protonen in water vormen een zuur. Als waterstof reageert kan het één elektron afgeven.
- Atoomnummer 2: In een heliumatoom zitten twee elektronen.
Omdat er twee mogelijkheden voor de spin zijn, kunnen die
allebei in het laagste energieniveau zitten. Doordat de kern
sterker positief geladen is dan bij waterstof, is de energie
van dit grondtoestandsniveau lager dan bij waterstof. De
waarde van Z is
groter. De elektronen zijn goed gebonden: het kost 24,6 eV om
het eerste elektron los te maken en 54,4 eV om het tweede los
te maken (dat laatste getal is vier keer zo groot als wat het
bij waterstof kost, dit komt door de factor Z2
in de energieniveaus).
Het kost veel energie om een elektron los te maken. Het is ook ongunstig om er een elektron bij te doen, want dat zou naar het volgende energieniveau moeten. Helium geeft niet gemakkelijk een elektron af en neemt er niet gemakkelijk een op. Het reageert dus niet met andere stoffen. - Atoomnummer 3 In een lithiumatoom moet het derde elektron naar het tweede energieniveau. Dat ligt een stuk hoger in energie. Het derde elektron is gemakkelijk los te krijgen: dat kost maar 5,39 eV. Dit element reageert gemakkelijk, doordat het gemakkelijk een elektron afgeeft. Vaak zie je als notatie ‘de elektronenverdeling is 2,1’. Dit betekent dat er twee elektronen in het eerste energieniveau zitten, en een in het tweede.
- Atoomnummers 4 tot en met 10: In de rest van de tweede rij
van het periodiek systeem wordt het tweede niveau gevuld, in
totaal kunnen er 8 elektronen in. Op zich is dit steeds
hetzelfde niveau met steeds meer elektronen er in, maar door
de steeds sterker positief geladen kern wordt de put steeds
dieper. De energiewaarde van het tweede niveau wordt steeds
lager. Daardoor kost het geleidelijk meer moeite om een
elektron los te maken. Bij Beryllium is dat 9,32 eV, bij Neon
21,57 eV.
Dit verklaart dat de plaats in de rij bepaalt hoe een element zich gedraagt in chemische reacties. Lithium geeft graag zijn derde, vrij los gebonden elektron af. Maar bij fluor, dat door de sterker geladen kern een lager gelegen tweede niveau heeft, is het juist heel gunstig een elektron op te nemen. Dat past nog in het tweede niveau, en de energie daarvan is laag. In een zout is fluor dan ook een negatief ion, in een scheikundige reactie neemt het graag een elektron op. - Atoomnummers vanaf 11: Natrium moet aan een volgend niveau beginnen. Dat elfde elektron, dat in het derde niveau komt, is weer heel los gebonden. Het kost slechts 5,14 eV om het los te maken. Natrium is in een zout een positief ion, en geeft in een reactie een elektron af.
- We kunnen nu ook begrijpen dat de drie elementen die in de linker kolom onder elkaar staan, waterstof, lithium en natrium, erg op elkaar lijken. Ze reageren alle drie heel gemakkelijk met andere stoffen. Ze hebben gemeenschappelijk dat ze alle drie één elektron in hun buitenste schil hebben. Voor waterstof is de buitenste schil ook de eerste schil, voor lithium is het de tweede schil, voor natrium de derde. Van de elektronen in de volle eerste en tweede schil merk je niet zoveel: als een ander atoom het natriumatoom nadert, krijgt het alleen te maken met het buitenste elektron. Zo’n buitenste elektron zit erg los, dat is de reden waarom deze drie elementen zo gemakkelijk reageren.
- Alle elementen in de rechterkolom hebben een volle buitenste schil. Het is ongunstig om een elektron op te nemen en ook om er een af te staan. Daardoor reageren ze niet gemakkelijk. Het zijn edelgassen.