Het elektron en het proton in het waterstofatoom ondervinden de aantrekking van de coulombkracht afhankelijk van hun afstand
Synopsis Quantummechanica II
Waterstofatoom
- Net als bij een quantumdeeltje in een put zijn de energietoestanden van een elektron in een coulombpotentiaal gequantiseerd.
- De energietoestanden berekend met dit model voor het waterstofatoom zijn omgekeerd evenredig met het kwadraat van het quantumgetal .
2.20
Voor dit geval is de 1-dimensionale (radiële) Schrödingervergelijking:
2.21
Hierin zijn en constanten en is de lading en de (gereduceerde) massa van het elektron.
Op de volgende pagina wordt berekend dat de energieniveaus gegeven worden door
2.22
- De constante is de rydberg-energie, met de bohrstraal. Hoe groter het getal , des te dichter liggen de energieniveaus bij elkaar.
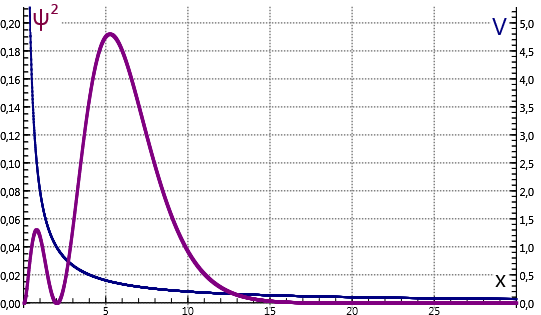
- De kans om het elektron op een afstand van de kern aan te treffen wordt bepaald door het kwadraat van de golffunctie . In de grondtoestand ligt het maximum bij de bohrstraal . De figuur is is getekend voor