Het elektron en het proton in een waterstofatoom ondervinden de aantrekking van de coulombkracht. Net als bij een quantumdeeltje in een put zijn de energietoestanden van het waterstof-elektron gequantiseerd:1 met de rydberg-energie. Hoe groter des te dichter liggen de energieniveaus bij elkaar.
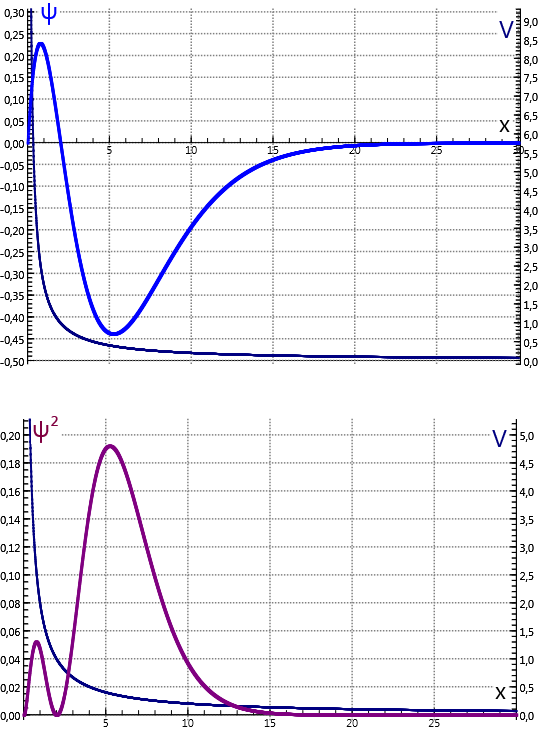
In de quantummechanica wordt het waterstof-elektron beschreven met een golffunctie . De kans om het elektron op een afstand van de kern aan te treffen wordt gegeven door het kwadraat van de golffunctie . In de grondtoestand ligt het maximum bij de bohrstraal , zoals in het voorbeeld berekend wordt.
Ter vereenvoudiging van de modelregels worden dimensieloze variabelen geïntroduceerd.